

药物临床试验是指以人体(患者或健康受试者)为对象的试验,意在发现或验证某种试验药物的临床医学、药理学以及其他药效学作用、不良反应,或者试验药物的吸收、分布、代谢和排泄,以确定药物的疗效与安全性的系统性试验。由此可见,药物临床试验的数据结果是验证药物安全性和有效性的重要依据,是药品上市的必经之路。
由于人体与动物对药物有效成分、药物毒性的反应不同,药物临床试验也具有了高风险、高投入、低成功率、时间跨度长等的特征。在PhRMA发布的《生物制药研发:新药背后的过程》中指出,受到科学进步、监管压力等多种因素的影响,新药研发过程的困难程度持续升高。平均而言,新药研发从最初发现到上市需要十年左右的时间,其中临床试验就需要6至7年。一种新药成功研发的成本为26亿美元。但与高昂的时间成本和资金压力相对的是新药研发的低成功率。在新药研发过程中要筛选数千甚至数百万的先导化合物,其中只有少数获批。就算已经进入临床试验,最终获批的可能性依然低于12%。
药物临床试验需要大量的人力和物力支撑。此前,由于我国经济发展的不平衡,市场无法支撑大量的药物临床试验,但是随着我国近年经济的快速发展和对药物研究的大量投入,我国药物研发蓬勃发展。
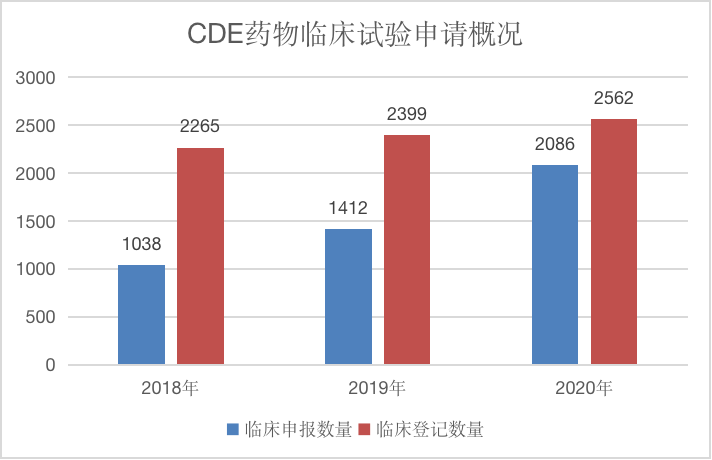
根据药智网发布的《2020年中国药物临床试验分析报告》(以下简称《报告》)显示,近三年药物临床申请以及药物临床试验登记数量都处于持续上升的状态,2020年共计2086个临床申请,同比增长48%,三年时间猛速增长了1048个临床申请,其批准率几乎为100%。另外药品审评中心(以下简称“CDE”)2020年药物临床试验登记公示的试验数量为2562,同比增长7%。
在药物种类方面,《报告》中指出2020年CDE登记公示的药物临床试验中化学药物占比高达74.98%,其次是生物制品,占比22.44%,中药/天然药物仅占2.58%。临床试验药物top10中除了排名第四的重组人源化抗PD-1单克隆抗体外全部是化学药物,其中用于治疗成人和青少年慢性乙型肝炎的富马酸丙酚替诺福韦片以24个临床试验排名第一,共有17个申办单位登记了该品种,而以23个临床试验排名第二的他达拉非片则由20个申办单位登记开展。
为鼓励药物临床试验的进行,满足不同药物临床试验要求的多样性,我国自2019年12月起临床试验机构正式实行备案制,截止2020年12月底进行药物临床试验备案的机构近1700家。但这并不意味着对药物临床试验开展标准的降低,相反2020年CDE登记开展的试验机构仅有340家。由此也印证了专家所说的“试验机构资格认定门槛低了,但对试验机构和参与方提出了更高的要求,体现了“宽进严出”的监管理念。
我国药品研发的蓬勃发展给我国带来技术创新的同时也对药品研发的流程规范和安全监管提出了新要求。在药品研发过程中,药物临床试验是验证和保障药物质量的重要一环,其数据的真实性将直接影响药物最终的安全性和有效性。同时,药物临床试验又具有高风险性。因此,为保障药物临床试验的安全进行和药品研发的可持续发展,我国近年来十分重视完善相关法律法规并加强国际间合作,力求构建较为完善的药物临床试验监管体系。
我国自2016年起对药品注册的审评审批制度进行改革,2017年国务院颁布了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)对药品注册提出了新要求。2019年新修订的《药品管理法》第17条明确要求保证药品研制全过程持续符合法定要求,并明确了监督主体为国务院药品监督管理部门。其后,国家药品监督管理局(简称“国家药监局”)于2020年4月23日发布最新《药物临床试验质量管理规范》(2020年第57号)作为药物临床试验监管的核心。
除此之外,我国在药物研发和质量控制上也积极与国际接轨,国家药监局于2017年6月加入国际人用药品注册技术协调会(ICH),并于2018年6月当选为ICH管委会成员。国家药监局积极协调将ICH原则在我国转化实施,推进我国药品监管国际化进程。在2021年6月3日,国家药监局正式连任ICH管委会成员。这意味着我国药品质量控制得到国际承认,为我国研制的药品走向国际市场创造了条件。
在药物临床试验中,受试者属于弱势群体,是绝大多数试验风险的直接承担者,因此,受试者权益保护一直都是药物临床试验的监管要点。我国建立了多种方式保护受试者的合法权益。法律要求申办方、研究者保护药物临床试验中受试者权益,实时关注受试者的用药情况、健康状态、临床数据的变化。另外,伦理委员会也应当特别关注处于弱势的受试者,审查受试者是否受到不正当影响,受理并处理受试者的相关诉求。
由此可以看出,临床试验的申办方、研究者等主体都对受试者的权益负有保障义务。因此,临床试验受试者的损害一旦发生,临床试验的申办方、研究机构/研究者甚至合同研究组织(Contract Research Organization, CRO)都有可能陷入法律风险之中。在此,康达律师事务所i医法律服务团队整理了近年来临床试验纠纷数据,从中挑选典型案例进行分析解读,以期为作为申办方的医药企业、CRO、参与研究的研究机构和研究者,从法律视角提供完善临床试验的相关管理、执行流程的思路,在保护受试者安全的前提下规避法律风险。
保障受试者权益是药物临床试验开展中的一项重要原则,我国法律法规从多角度全方位保护受试者权益。临床试验的申办方、研究者和伦理委员会都负有保护受试者权益的义务。我国《药品管理法》、《药物临床试验质量管理规范》和《涉及人的生物医学研究伦理审查办法》等法律法规对受试者的知情同意权、隐私权和获得补偿赔偿的权利都有详细规定。
1.受试者的知情同意权保护
2.受试者的隐私权保护
在临床试验过程中,会产生与受试者相关的多项医疗数据。受试者的健康信息、生物识别信息等个人信息都将被详细记录。因此,保护受试者隐私是药物临床试验过程中的重要内容,受试者也应当遵循保密原则,防止信息泄露。
在2020年新发布的《药物临床试验质量管理规范》第24条中明确规定,受试者相关身份鉴别记录的保密事宜,不公开使用。如果发布临床试验结果,受试者的身份信息仍保密。在临床试验的信息和受试者信息处理过程中应当注意避免信息的非法或者未授权的查阅、公开、散播、修改、损毁、丢失。临床试验数据的记录、处理和保存应当确保记录和受试者信息的保密性。
在临床试验过程中,研究者负责试验过程中的安全性报告。在严重不良事件报告和随访报告要求注明受试者在临床试验中的鉴认代码,而不是受试者的真实姓名、公民身份号码和住址等身份信息。
3.药物临床试验的补偿赔偿原则
药物临床试验不同于常规治疗手段,其不确定风险显著增高。因此根据公平原则,药物临床试验应当遵循免费和补偿的原则。不得向参加研究的受试者收取任何费用,对于受试者在受试过程中支出的合理费用还应当给予适当补偿。受试者参加研究受到损害时,应当得到及时、免费治疗,并依据法律法规及双方约定得到赔偿。为保障受试者切实能够得到相应补偿,我国最新修订的《药物临床试验质量管理规范》第12条中规定伦理委员会应当确保知情同意书、提供给受试者的其他书面资料说明了给受试者补偿的信息,包括补偿方式、数额和计划。
除了研究者应当向受试者说明补偿信息之外,药物临床试验的申办方还应当采取适当方式保证受试者免费参与临床试验,并给予受试者补偿或赔偿。
《药物临床试验质量管理规范》(2020版)第39条中详细规定了申办方的负担范围。
首先,申办方应当免费向受试者提供试验用药品并支付与临床试验相关的医学检测费用。
其次,申办方应当向研究者和临床试验机构提供与临床试验相关的法律上、经济上的保险或者保证,并与临床试验的风险性质和风险程度相适应。但不包括研究者和临床试验机构自身的过失所致的损害。
最后,申办方应当承担受试者与临床试验相关的损害或者死亡的诊疗费用,以及相应的补偿。申办方和研究者应当及时兑付受试者的补偿或者赔偿。
综上,在临床试验中,受试者一旦发生与临床相关的损害或者死亡的情形,申办方无论有无过错,都应当承担相应的补偿或赔偿责任。如果受试者遭受损害或死亡是因研究机构或研究者过错造成,申办方可以向研究机构或研究者追偿。
地 址: 北京市朝阳区建外大街丁12号英皇集团中心8层,邮编:100022
电 话:(010) 5086 7666
传 真:(010) 5691 6450
地 址: 西安市雁塔区太白南路139号荣禾云图中心7层、15层,邮编:710061
电 话:(029)8836 0129
传 真:
地 址: 深圳市福田区中心四路一号嘉里建设广场1期19楼,邮编:518046
电 话:(0755)8860 0388
传 真:
地 址: 海口市美兰区碧海大道86号华彩·海口湾广场A座1008、1009,邮编:570208
电 话:(0898)6625 4181
传 真:(0898)6625 5316
地 址: 上海市黄浦区中山南一路768号博荟广场C座905室,邮编:200023
电 话:(021)6390 1100
传 真:
地 址: 广州市天河区珠江东路32号利通广场29层2901室,邮编:510510
电 话:(020)3739 2666
传 真:
地 址: 杭州市上城区西子国际中心2号楼1501-1503室,邮编:310002
电 话:(0571)8577 9929
传 真:
地 址: 沈阳市和平区南湖街道青年大街390号皇朝万鑫大厦C座21层,邮编:110004
电 话:(024)2250 3388
传 真:
地 址: 南京市建邺区应天大街888号金鹰世界A座26层,邮编:210008
电 话:(025)8411 1616
传 真:
地 址: 天津市河北区海河东路78号茂业大厦2601室,邮编:300141
电 话:(022)2445 9827
传 真:
地 址: 菏泽市开发区人民路菏建·数码大厦B座西单元19层,邮编:274005
电 话:(0530)5566 148
传 真:
地 址: 成都市锦江区东御街18号百扬大厦1栋11层1101室,邮编:610020
电 话:(028)8774 7485
传 真:
地 址: 苏州市工业园区九章路69号理想创新大厦A幢12层,邮编:215316
电 话:(0512)6758 6952
传 真:(0512)6758 6972
地 址: 呼和浩特市金桥开发区昭乌达路宇泰商务广场A座11层1101室,邮编:010041
电 话:(0471)5166 277
传 真:
地 址: 九龍渡船街38號建邦商業大廈1樓5號室
电 话:(00852)2333 9989
传 真:(00852)2333 9186
地 址: 武汉市江岸区中山大道1627号中信泰富大厦20层,邮编:528451
电 话:(027)5926 5991
传 真:
地 址: 郑州市金水区郑东新区农业南路51号楷林中心10座12层,邮编:450046
电 话:(0371)8895 9887
传 真:
地 址: 长沙市雨花区芙蓉中路三段567号第六都兴业IEC32层,邮编:410021
电 话:(0731)8218 3551
传 真:(0731)8218 3551
地 址: 厦门市湖里区高林中路469号新景地大厦23层,邮编:361016
电 话:(0592)5211 009
传 真:
地 址: 重庆市江北区桂花街支路10号成大锦嘉国际大厦10层,邮编:400020
电 话:(023)6775 9966
传 真:
地 址: 合肥市蜀山区政务区华润大厦西塔B座30层,邮编:230071
电 话:(0551)62930997
传 真:
地 址: 宁波市鄞州区三眼桥街51号宁铸中心5号楼27层(宁波塔-27F),邮编:315199
电 话:(0574)8737 8737
传 真:
地 址: 济南市高新区舜泰北路舜泰广场933号博晶大厦25层2513室,邮编:250101
电 话:(0531)8828 5613
传 真:
地 址: 昆明市西山区融城优郡B幢10楼,邮编:650034
电 话:(0871)6517 9639
传 真:
地 址: 南昌市红谷滩区红谷中大道1391号华皓中心53层,邮编:330038
电 话:(0791)8678 9099
传 真:
康达律师事务所(以下简称“本所”)是一家设立于中国的综合性律师事务所。本所网站上的信息仅供您参考,不应视为本所为本网站访问者就特定事项提供的法律意见或建议,本网站访问者不应将其作为作为或不作为的依据。
本所对本网站及网站所包含的文字及图片等各类信息拥有知识产权,未经授权,请勿转载或使用。
本网站超链接的第三方网站不受本所控制,仅为您方便之需,本所不对该等网站的访问者承担任何明示、默示的担保或责任。
欢迎访问本网站,如有任何问题,请与本所联系。